発症初期においては、LICsは骨髄内に存在する多数の正常造血幹/前駆細胞(hematopoietic stem/progenitor cells; HSPCs)との相互作用のもとで、骨髄内において徐々に増殖すると考えられている。
従来のCMLのマウスモデルとしては、放射線を致死レベル照射し、骨髄内のHSPCsを枯渇させたマウスに、BCR-ABL発現LICsを静脈内投与して、CMLを発症させている。しかしながら、このモデルとは異なり、少数のLICsが多数のHSPCの共存下で、徐々に増殖するという、CMLの初期過程を反映するモデルとして、BCT-ABL遺伝子導入して得られたLICsを、放射線非照射のヌードマウスの骨髄内に直接接種することで発症させるCMLモデルを、我々は初めて確立した。
このモデルの解析を通して、CMLの発症過程において、白血病細胞がケモカインCCL3を産生することを認めた。しかも、産生されたCCL3が骨髄内のHSPCsに作用し、HSPCsを骨髄外へと流出させることを通して、白血病細胞が増殖するために必要なスペースを確保し、その結果CMLが発症することを明らかとなった(Baba et al., 2013)。
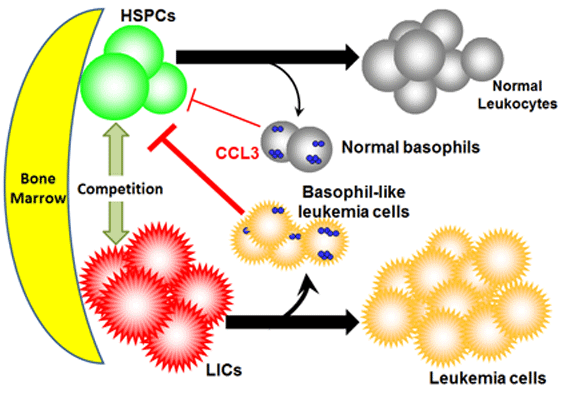
その後の解析から、正常骨髄においても好塩基球が恒常的にCCL3を産生していて、骨髄移植時などのストレス下での正常HSPCsの増殖の過剰な増殖を抑制していることを明らかにした。
マウスCMLモデル・ヒトCML患者の骨髄内においても、増加することが知られていた好塩基球様細胞がCCL3を過剰に産生していることが明らかになった。マウスCMLモデルの発症過程で、好塩基球を除去すると、CCL3が欠如している場合と同様に、CMLの発症が抑制された。以上の結果から、好塩基球様白血病細胞が産生するCCL3が、骨髄内ニッチを巡ってCMLのLICsと競合状態にあるHSPCsの増殖を抑制することで、CMLの白血病幹細胞の増殖に有利な環境を作っていると考えられた(下図) (Baba et al., 2016)。したがって、好塩基球やCCL3は、CML治療のうえでの新たな標的となる可能性が示唆された。
このページのトップ