このページのトップ
大腸がん発症進展過程での腫瘍関連線維芽細胞(CAF)の役割
潰瘍性大腸炎患者では、大腸がんの発生率が正常人に比べて高いことなどから、慢性炎症反応が大腸がんの発生に関与していることが想定されている。
マウスにO6-メチルグアニン産生誘導のあるアゾキメタン(AOM)を投与後に、デキストラン硫酸(DSS)溶液を頻回反復飲用させると、大腸炎の発症後に、大腸にβカテニンの核内集積を認める腫瘍が多発する。このモデルでは、転写因子NF-κBの活性化が発がんに密接に関与していることが報告されている。我々は、このモデルの解析を通して、NF-κBの強力な活性化因子である腫瘍壊死因子(TNF)やケモカインCCL2が、サイクロオキゲナーゼ(COX)-2を発現している白血球浸潤を引き起こすことによって、大腸がん発症に関与している可能性を明らかにした(Popivanova BK et al, 2008)(Popivanova BK et al, 2009)。
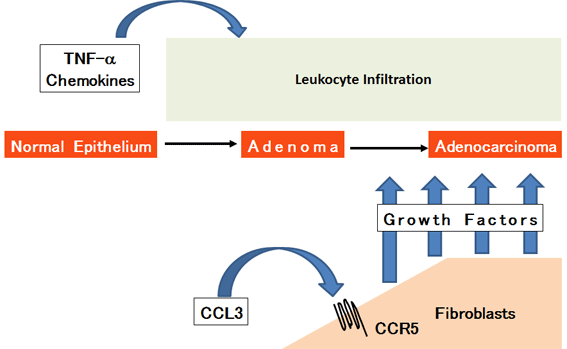
このモデルのその後の解析から、大腸がんの進展過程には、線維芽細胞の集積が不可欠であることが明らかになった。さらに、大腸組織で産生されるケモカインCCL3が、その特異的レセプターであるCCR5を発現している線維芽細胞の集積を促すことで、線維芽細胞が種々の増殖因子をがん細胞に供給していることも明らかになった。このような細胞・分子機構は、AOM/DSS誘発大腸がんモデルのみならず、マウス大腸がん株の皮下ならびに盲腸内への同種移植時にも認められることも明らかになった(下図)。(Sasaki et al., 2014)
ヒトならびにマウス結腸がん細胞株を盲腸壁に接種する後に、CCR5阻害剤であるmaravirocを投与することによって、腫瘍関連線維芽細胞(Cancer-associated
fibroblasts, CAFs)が減少するとともに、腫瘍形成も抑制された(Tanabe et al., 2016)。したがって、CCR5系を介するCAFの制御が、大腸がん治療の新たな戦略になる可能性が示唆された。