セリン/スレオニン・キナーゼ活性を保有する原癌遺伝子 Pim-3の種々の癌における発現亢進
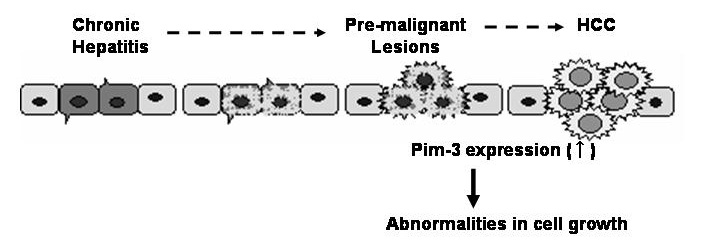
ヒトB型肝炎ウイルス表面抗原(HBs)トランスジェニック・マウスに、HBsで免疫したリンパ球を移入することによって生じる肝癌モデルは、ヒトの肝癌発症過程の一部を反映しているモデルである。炎症によって生じる癌化過程の分子機構の解明のために、蛍光ディファレンシャル・ディスプレイ法で、このモデルにおいて生じる前癌病変で選択的に発現している遺伝子群の包括的な検索をおこなった。.
その結果、前癌病変で選択的に発現していた遺伝子として、セリン・スレオニンキナーゼ活性を保有する原癌遺伝子ファミリーに属するPim-3を同定した。ヒトではPim-3の全長cDNAが報告されていなかったことから、全長cDNAの全塩基配列を決定した。その結果、Pim-3 cDNAは2,392塩基からなり、326アミノ酸からなるキナーゼをコードしていることを明らかとなった(Human Pim-3)。
Pim-3 mRNAはヒト正常肝組織では発現していないのに対して、肝癌細胞株では恒常的に発現していた。Pim-3タンパクはヒト肝癌組織・肝癌細胞株では検出されるのに対して、正常肝細胞では検出されなかった。さらに、RNA干渉法で肝癌細胞株でのPim-3発現を抑制すると、肝癌細胞株の増殖は遅延するとともに、アポトーシスが亢進した
(Fujii et al., 2004)。

同様の結果は、膵臓癌においても同様のことが認められた。さらに、ヒト膵臓癌細胞株での解析から、異常発現しているPim-3が、好アポトーシス分子であるBadの112番目のセリン残基をリン酸化することによって、不活化し、アポトーシスを抑制していることが明らかになった(下図参照、Li et al, 2006.)。
さらに、Pim-3遺伝子を肝臓特異的に発現しているマウスでは、肝臓がんは自然発症しなかったが、肝臓がんを誘発することが知られているDiethylnitrosamineを投与すると、肝臓がんの発症頻度が上昇するとともに、発生した肝臓がんの大きさも増大した。すなわち、Pim-3はがんのiniatorとして作用していると考えられた(Wu et al, 2010.)。
以上の結果は、Pim-3が幾つかの癌において、例えば代表的な難治性の癌である膵癌の治療の分子標的である可能性を強く示唆している(Mukaida et al., 2011)。
このような想定のもと、Pim-3キナーゼ活性阻害を指標に、種々の低分子化合物のスクリーニングを行い、これまでに幾つかの低分子化合物がPim-3活性を阻害するとともに、膵臓がん細胞株などの試験管内増殖や、マウス個体内での増殖を抑制することを見出し、特許申請を行っている。