組織・研究分野
先進がんモデル共同研究センター
Innovative Cancer Model Research Center
上皮幹細胞研究分野
Division of Epithelial Stem Cell Biology
スタッフ

客員教授
ニコラス バーカー
Nicholas Barker

准教授
村上 和弘
Murakami Kazuhiro
目的と研究課題
マウス生体内の細胞系譜トレーシング法やオルガノイド培養法の研究開発により, 胃正常上皮幹細胞の自己複製能や, 胃がん幹細胞の制御機構の解明を目指す。得られた知見を元に, 組織幹細胞の再生能力を生かした再生医療や, 幹細胞を標的としたがん促進機構の制御による新しいがんの予防・治療法の開発へと展開する。
【新規ヒト胃組織幹細胞, 胃がん幹細胞を特定】
マーカー遺伝子が知られていなかったため, ヒトにおける胃組織幹細胞の存在は明らかになっていませんでした。本研究では, ヒト胃幽門前庭部の組織幹細胞で膜タンパク質AQP5が特徴的に発現していることを発見しました。さらに, 遺伝子変異の蓄積したAQP5陽性胃がん細胞は, がん幹細胞様の性質を持つことを明らかにしました (Tan SH et al., Nature, 2020)。
【胃組織幹細胞の幹細胞性を制御する新規遺伝子の同定】
胃組織幹細胞の幹細胞性を制御する分子機構は謎に包まれたままでした。生体内の組織構造・組織機能を模倣できるオルガノイドと, 任意の遺伝子機能を破壊できるGenome-Scale CRISPR Knock-Outスクリーニング法を組み合わせ, 胃組織細胞の幹細胞性を制御する新たな遺伝子Alk, Bclaf3, Prkraを同定しました(Murakami K, Barker N, et al., PNAS, 2021)。
【新規胃がんマウスモデルの解析を通した胃がん幹細胞の発見】
胃がんの浸潤・転移を再現できるマウスモデルが存在しないことが, 効果的な治療法の確立を妨げていました。進行胃がんを模倣する新規マウスモデルを確立し, 生体内における機能的な解析を通して, 胃がんの発生と維持に必須な胃がん幹細胞を発見しました (Fatehullah A, Terakado Y et al., Nat Cell Biol., 2021)。
図1. AQP5陽性細胞はがん幹細胞様の性質を示す
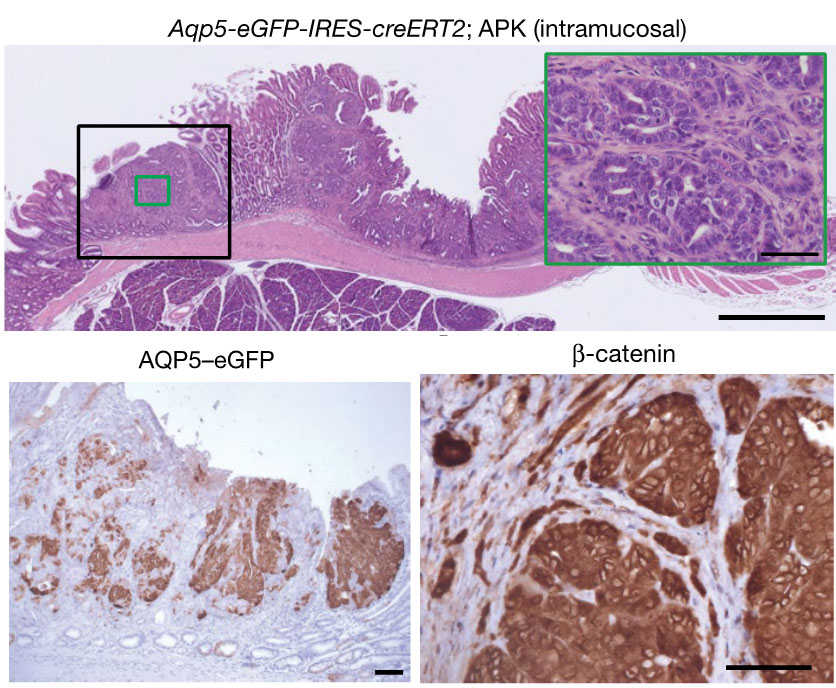
Wntシグナル経路の活性化によって生じる初期胃がんの進展に, 組織幹細胞が深く関与していることを明らかにした。さらに, 変異の蓄積したAQP5陽性組織幹細胞は, 胃がん幹細胞として振る舞うことも明らかにした。
(Tan SH et al., Nature, 2020より引用)
図2. Alk,Bclaf3,Prkraは胃組織幹細胞の幹細胞性を決定する新たな遺伝子である
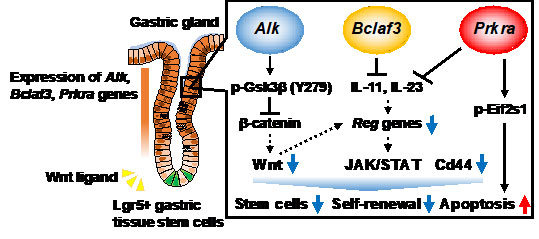
AlkはGSK3βをリン酸化することで不安定化しWntシグナルを抑制する。一方で, Bclaf3, Prkraはインターロイキン11 (IL-11)および23(IL-23)の発現抑制を通して, 胃上皮細胞の増殖に必須なReg遺伝子の発現を負に制御する。
(Murakami K, Barker N et al., PNAS, 2021より引用)


