組織・研究分野
先進がんモデル共同研究センター
Innovative Cancer Model Research Center
腫瘍遺伝学研究分野
Division of Genetics
スタッフ

教授
大島 正伸
Oshima Masanobu

准教授
大島 浩子
Oshima Hiroko

准教授
中山 瑞穂
Nakayama
Mizuho

特任助教
WANG Dong
(ナノ研籍)
目的と研究課題
腫瘍遺伝学研究分野では,胃がん,大腸がん,胆管•膵臓がんなどの消化器がんの発生および悪性化に関して,ゲノム変異と宿主反応の相互作用に着目しながらメカニズム解明を目指して,新規マウスモデルやオルガノイドを樹立し,移植による転移モデルなどを用いて以下の研究プロジェクトを推進しています。
【RNF43 変異によるWnt依存的大腸がん発生】
ヒト大腸がん原発巣から樹立したオルガノイドのゲノム解析により,RNF43 変異型オルガノイドはWntリガンド依存的に生存・増殖することを明らかにした。また,PDXモデルを用いた研究により,RNF43 変異大腸がんに対して,Wntリガンド阻害薬に治療効果がある事を示しました(Yamamoto D, et al, J Pathol, 2022)。
【ネガティブ選択による悪性がん細胞集団の進化】
ドライバー変異を蓄積した転移性腸管がん由来オルガノイド(AKTP)を用いて,がん細胞の多様性を,サブクローニングにより解析した結果,転移能を消失する細胞集団が一定頻度で出現し,それらが集団から排除される可能性があることを明らかにしました。(Morita A, et al, Cancer Sci, 2023)。
【Kras/p53変異とTGFβシグナルによる悪性化機構】
マウス腸管腫瘍由来オルガノイドを用いた解析により,Kras G12Dとp53 R270Hの双方に変異を持った腫瘍細胞は,TGFβファミリーのアクチビンによる刺激を受けると,EMTを起こしクラスターを形成して原発巣から遊離し,細胞外基質に浸潤することを観察しました。(Wang D, et al, Cancer Res 2024)。
図1. 転移性消失がん細胞のネガティブ選択機構
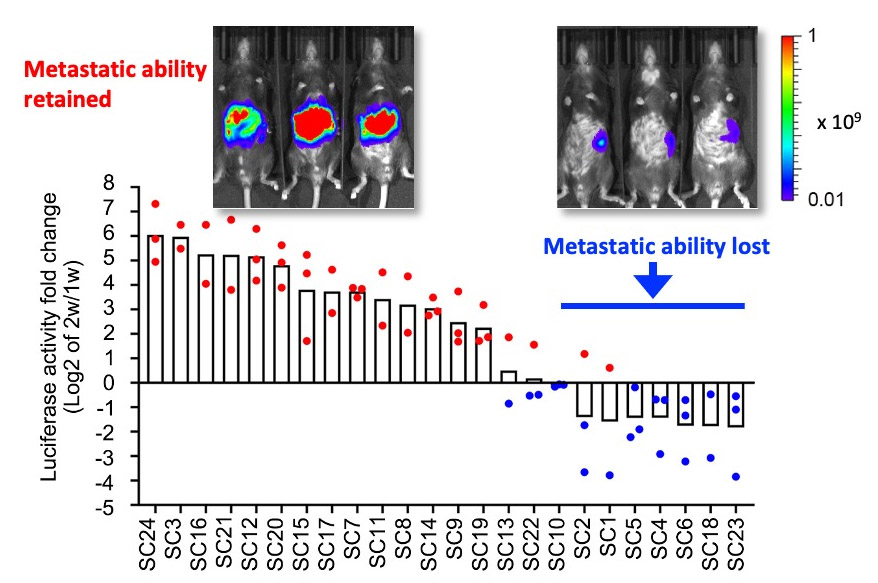
転移性のAKTP細胞を構成する細胞集団の約30%で転移性を消失していることが,イメージング解析により認められた。これらの細胞は,生体内の腫瘍組織からネガティブ選択機構により排除されているようだ。
(Morita A, et al, Cancer Sci, 2023より引用)
図2. Kras/p53変異とTGFシグナルによる悪性化進展
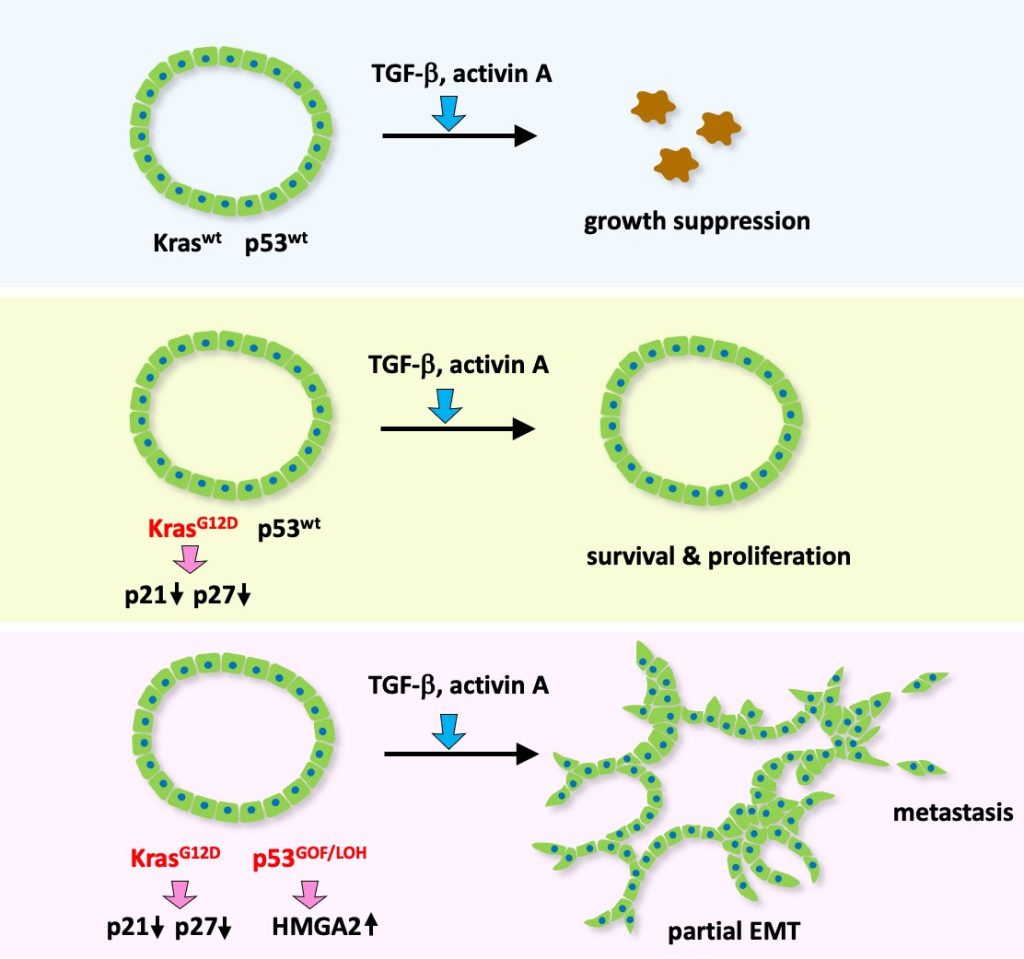
Kras/p53野生型の腫瘍細胞はTGF/activinにより増殖抑制する(図上),Kras変異により抵抗性を示す(図中)。さらにp53に変異が入ると,TGF/activin刺激によりEMTを起こし,クラスターを形成して原発巣から遊離,浸潤する。
(Wang D, et al, Cancer Res, 2024より引用)


