組織・研究分野
がん分子標的検索プログラム
Cancer Molecular Target Exploration Program
機能ゲノミクス研究分野
Division of Functional Genomics
スタッフ

教授
鈴木 健之
Suzuki Takeshi

助教
石村 昭彦
Ishimura Akihiko
目的、研究課題、最近の主な成果
がんの発症・悪性進展の分子メカニズムを理解するためには、それに関与する遺伝子変異や遺伝子発現異常を見つけることが極めて重要である。レトロウイルス感染発がんモデルマウスでは、ウイルスがゲノムに挿入し、遺伝子変異や周辺遺伝子の発現異常によってがんを誘発するため、ウイルス挿入部位を解析することで原因遺伝子を容易に同定することができる。本研究分野では、ウイルス感染マウスを用いてがん関連遺伝子を網羅的に同定し、その機能や相互作用の解析を通して、新しいがん分子標的の探索や先進的ながんの遺伝子診断法の確立を目指している。また、重要な標的遺伝子については、逆遺伝学的手法で新たな疾患モデルマウスを作製し、個体レベルでのがんの病態解析や治療法の開発に活用することも目標にしている。現在の主な研究テーマは次のとおりである。
- レトロウイルス感染発がんモデルマウスを利用した新しいがん関連遺伝子の単離と機能解析
- ヒストンのメチル化酵素および脱メチル化酵素とがんの発症・悪性化との関係
- 長鎖非コードRNAのがん悪性進展における役割
- RNAのメチル化修飾を制御する因子とがん悪性進展との関係
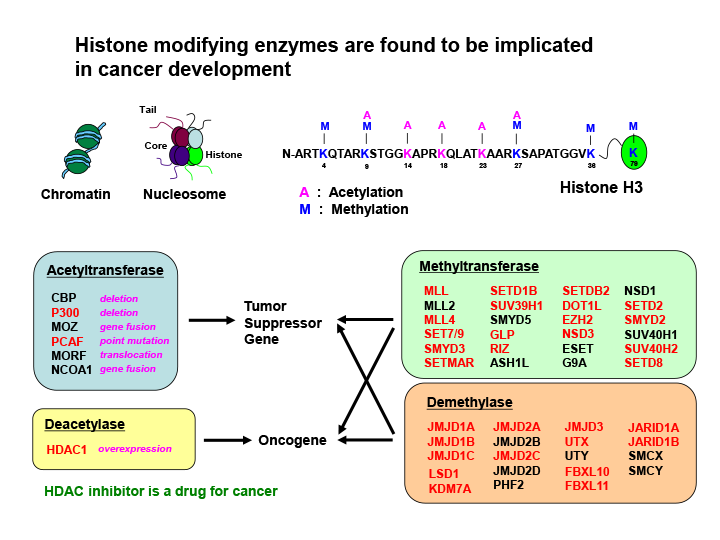
図1 ヒストンのメチル化を制御する酵素の多くは、ウイルス挿入変異の標的となっている
ヒストンの翻訳後修飾は、転写制御、X染色体不活性化など様々な生物学的現象に関与している。アセチル化と発がんの関係は重要で、脱アセチル化酵素の阻害剤が抗がん剤として開発されている。私たちはこれまでに、ヒストンのメチル化を制御する酵素の多く(赤色で示す)が、ウイルス挿入の標的となることを発見し、発がんにおけるヒストンのメチル化修飾制御の重要性を明らかにしてきた。
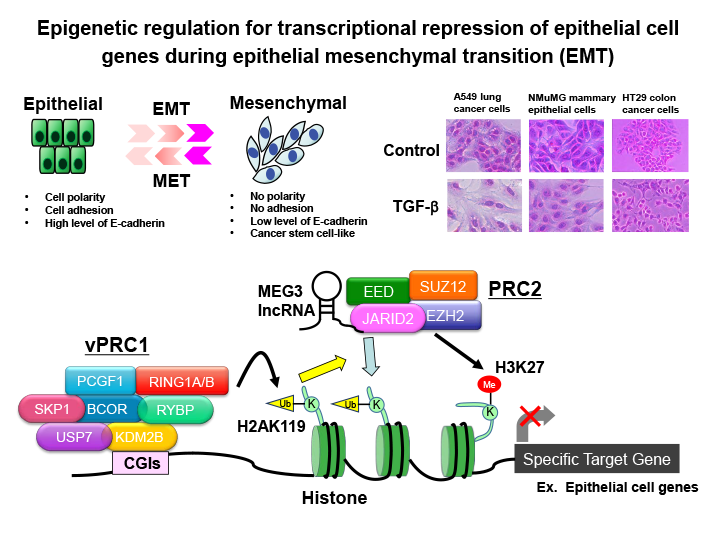
図2 がん細胞の上皮間葉転換における上皮系遺伝子の転写抑制のエピジェネティック制御
がん細胞の上皮間葉転換(EMT:上皮細胞が細胞間接着能を喪失し、運動性の高い間葉系細胞へと性質が変化する現象)は、転移の引き金になると考えられている。EMTが進行する際には、E-cadherinなどの上皮系遺伝子の転写抑制とN-cadherin, Vimentinなどの間葉系遺伝子の発現上昇が起きる。私たちは、様々なエピジェネティック制御因子(PRC2ヒストンメチル化酵素複合体、PRC1ヒストンユビキチン化酵素複合体、長鎖非コードRNAなど)が上皮系遺伝子の転写抑制に関与していることを明らかにした。


