組織・研究分野
先進がんモデル共同研究センター
Innovative Cancer Model Research Center
腫瘍遺伝学研究分野
Division of Genetics
スタッフ

教授
大島 正伸
Oshima Masanobu

准教授
大島 浩子
Oshima Hiroko

准教授
中山 瑞穂
Nakayama
Mizuho

特任助教
WANG Dong
(ナノ研籍)
目的と研究課題
腫瘍遺伝学研究分野では、胃がん、大腸がん、胆管•膵臓がんなどの消化器がんの発生および悪性化に関して、遺伝子変異と宿主反応の相互作用に着目しながらメカニズムの解明を目指した研究を推進しています。とくに、新規マウスモデルの開発やオルガノイドの移植による転移モデルを用い研究により、以下のプロジェクトを展開しています。
【Kras/p53変異とTGFβシグナルによる悪性化機構】
マウス腸管腫瘍由来オルガノイドを用いた解析により、Kras G12Dとp53 R270Hの双方に変異を持った腫瘍細胞は、TGFβファミリーのアクチビンによる刺激を受けると、EMTを起こしクラスターを形成して原発巣から遊離し、細胞外基質に浸潤することを明らかにしました。(Wang D, et al, Cancer Res 2024)。
【ヒト大腸がん肝転移におけるクローンの中立進化】
ヒト大腸がん組織からシングルセル由来サブクローンを樹立して標識し、マウス脾臓移植による肝転移巣形成過程を経時的に追跡解析した結果、転移巣形成過程ではサブクローンの中立的な選択と増殖が認められることを明らかにしました。(Lei X, et al, J Biochem, 2024)。
【ミスセンスp53変異による腫瘍内Wnt活性化機構】
ミスセンス型p53変異は新たに発がん促進機構を獲得すると考えられています。マウスおよびヒト腸管がん組織内では、ミスセンス変異p53がCOX-2遺伝子発現を誘導し、下流で生合成するPGE2が周囲の腫瘍細胞のWntシグナルを活性化して、細胞増殖を亢進することを明らかにしました。(Nakayama M, et al, Cancer Res Commun 2025)。
図1. 大腸がん肝転移巣形成における中立進化
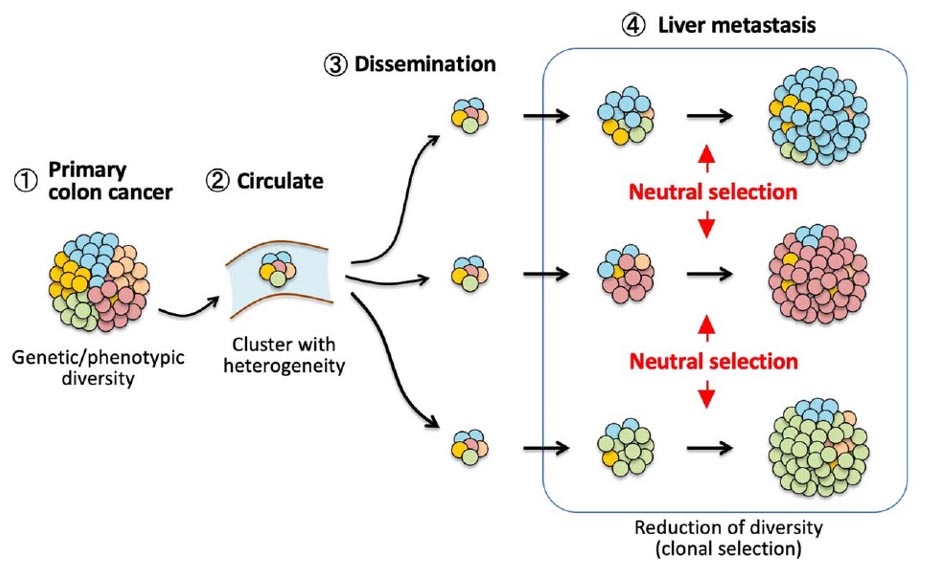
大腸がん原発巣(①)から遊離したがん細胞クラスターが血流を介して(②)、多様性を維持したまま肝臓に到達し(③)、転移巣を形成する過程では、意のサブクローンが中立的に任選択されて増殖する(④)中立進化が認められる
(Lei X, et al, J Biochem, 2024)
図2. ミスセンス変異p53による腫瘍内Wnt活性化
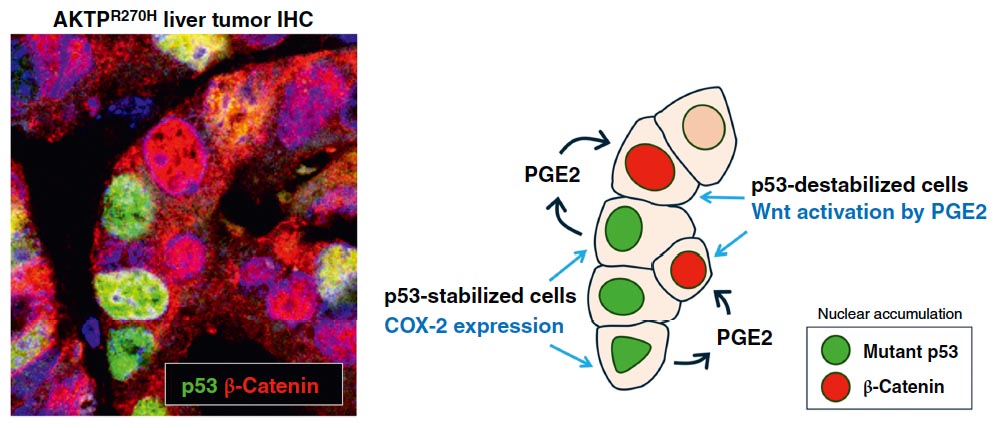
ミスセンス変異p53が安定化した腫瘍細胞では、COX-2発現が誘導され、PGE2を産生する。細胞外に分泌したPGE2は、周囲のp53が安定化していない腫瘍細胞に作用して、Wntシグナを活性し、細胞増殖を亢進する。
(Nakayama M, et al, Cancer Res Commun, 2025)


