組織・研究分野
がん微小環境研究プログラム
Cancer Microenvironment Research Program
腫瘍細胞生物学研究分野
Division of Tumor Cell Biology and Bioimaging
スタッフ

教授
平田 英周
Hirata Eishu

助教
石橋 公二朗
ISHIBASHI Kojiro

特任助教
LEE WAI TIK
目的、研究課題、最近の主な成果
プロテインキナーゼをコードするがん遺伝子の発見以来、その活性阻害はがんに対する薬物療法の切り札として期待され、実際にAbl、EGFR、BRAF等に対する選択的阻害薬は大きな臨床的成果を挙げてきた。しかしながら一方で、これらに対する薬剤耐性の出現が現代のがん医療が直面する最も大きな課題の一つとなっている。我々はこれまでに、メラノーマ微小環境に存在する線維芽細胞がBRAF阻害剤に対する一時的な薬剤耐性環境 “safe haven” の成立に重要な役割を担うことを明らかにしてきた。また実験的・臨床的解析の両面から、がん薬物療法に対する応答には臓器特異性が存在することも明らかにしてきた。これらはすなわち、がん治療においては腫瘍微小環境がもたらす影響を最大限に考慮する必要があることを示唆している。
本研究室では、がん遺伝子情報に基づいた治療戦略に臓器特異的腫瘍微小環境を標的とした治療戦略を組み合わせることを「次世代型プレシジョン医療」と位置付け、腫瘍微小環境によるがん細胞修飾機構を明らかにし、これを臨床応用へと展開することを目標とする。特に中枢神経系微小環境におけるがん細胞と間質細胞の双方向性エピジェネティクス制御機構と薬剤耐性、神経免疫システム再構成への関わりに着目し、外科的に治癒を得ることができない原発性・転移性脳腫瘍に対する革新的治療戦略を確立することに挑戦する。
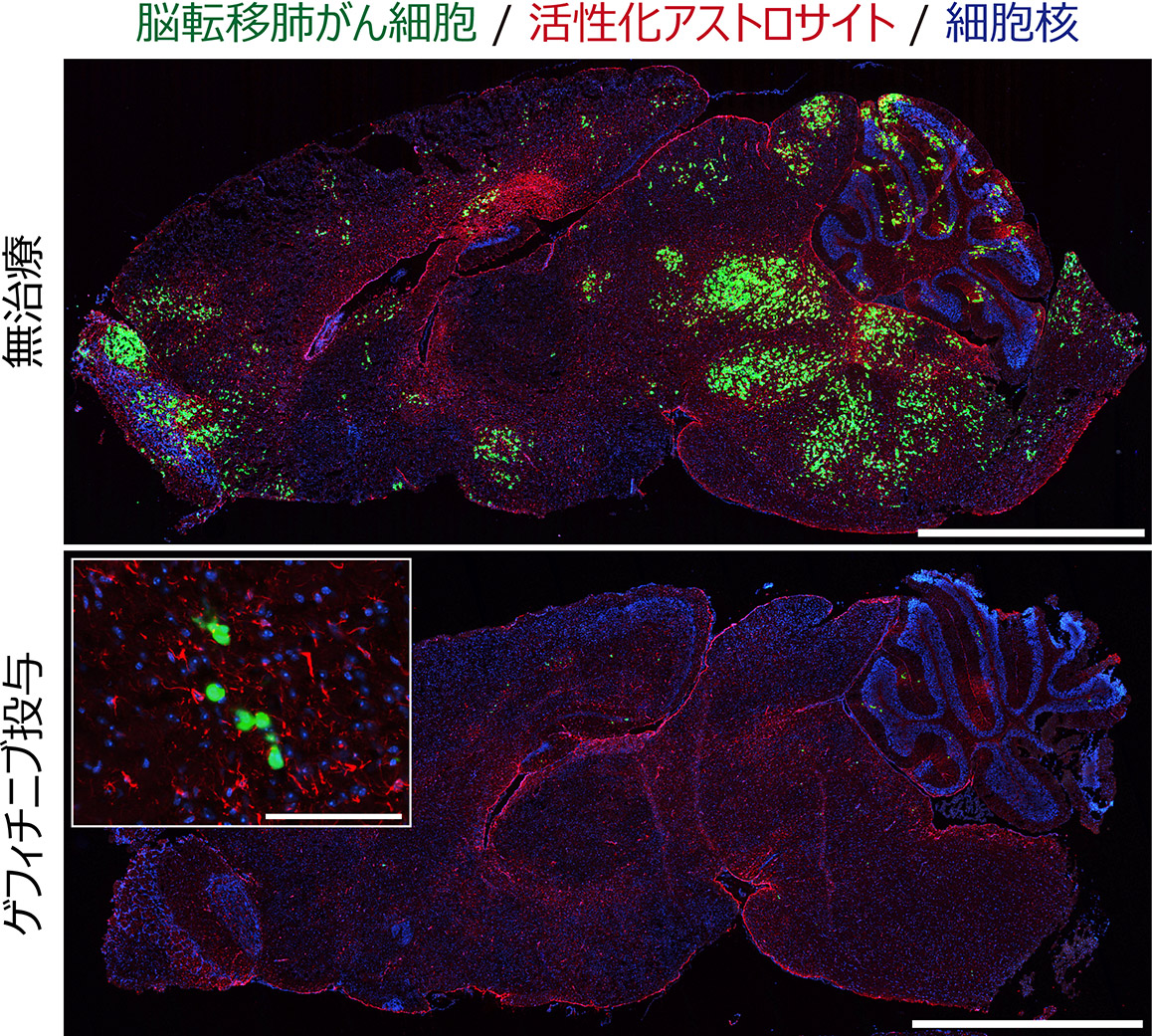
図1 脳転移肺がん細胞の薬剤応答と薬剤耐性
EGFR変異を有する脳転移肺がん細胞はEGFR阻害剤(ゲフィチニブ)に良好に応答する。 しかしながらがん細胞は完全には死滅しておらず、再発の母地となり得る微小残存病変を形成する。
スケール:2.5mm(大パネル) / 100 mm(小パネル)


