組織・研究分野
がん分子標的検索プログラム
Cancer Molecular Target Exploration Program
ゲノム生物学研究分野
Division of Genome Biology
スタッフ

教授
磯崎 英子
Isozaki Hideko

准教授
酒井 克也
Sakai Katsuya

特任助教
Yilmaz Neval
(ナノ研籍)
目的、研究課題、最近の主な成果
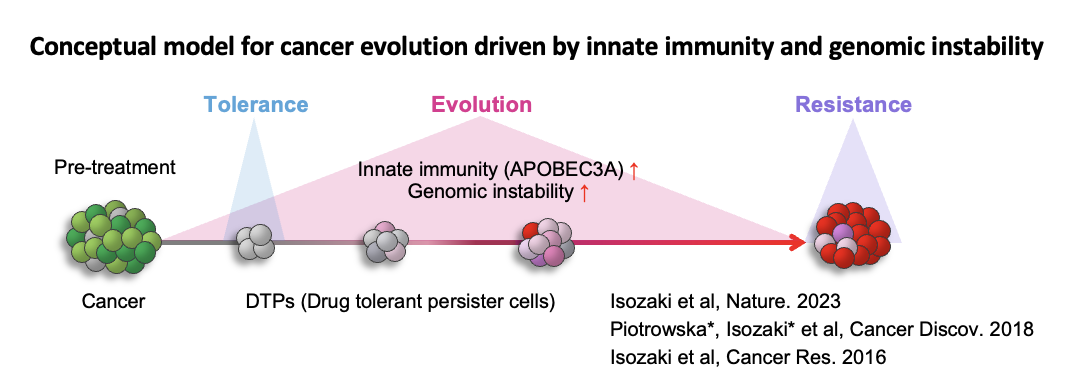
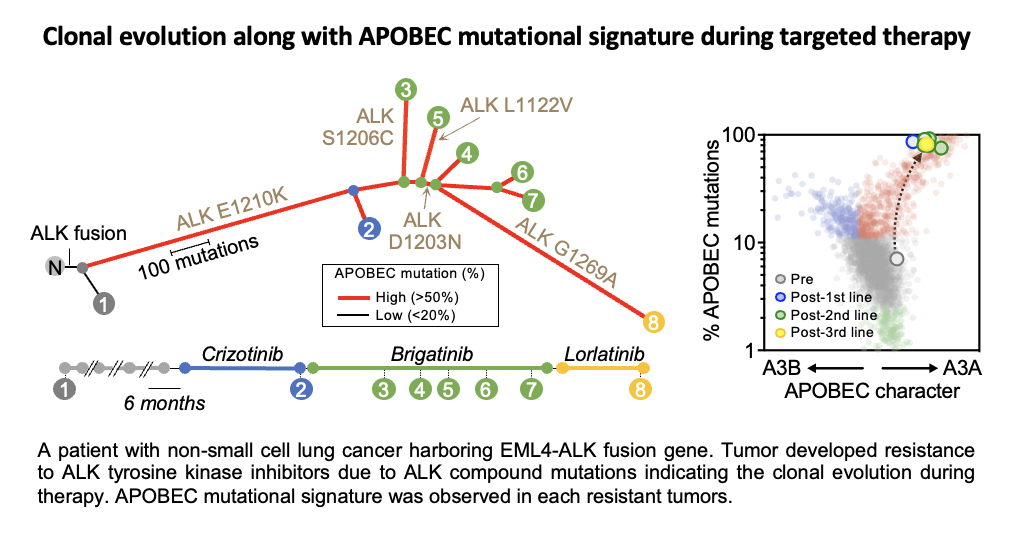
近年、ゲノムの異常ががんの発生や薬剤耐性の原因であることが明らかになっています。外的刺激(紫外線、喫煙、薬剤、ウイルス感染、加齢など)によって、単一細胞の核内DNAに変異が蓄積され、それが様々な細胞生理機能に異常を引き起こし、最終的に発がんや治療抵抗性へと繋がります。この現象は「クローン進化」と呼ばれ、がんゲノムが時間とともに複雑化していく過程を反映しています。遺伝子変異の誘発メカニズムは完全には解明されていませんが、いくつかの因子が特定されています。その一つがシチジン脱アミノ化酵素であるAPOBECです。APOBECは、DNAやRNA上のTpCモチーフにおけるシチジンを脱アミノ化し、ウリジンに変換します。私たちの最近の研究では、肺がんの分子標的治療がAPOBEC3Aの発現を誘導することを発見しました。APOBEC3Aによる体細胞突然変異や染色体異常の生成がゲノムの不安定性を高め、それが薬剤耐性クローン細胞の進化を促進し、最終的に薬剤耐性を引き起こすことが示されました。このように、APOBEC3Aを阻害することで薬剤耐性を未然に防ぐ可能性が示唆されました(Isozaki et al. Nature 2023)。この研究成果を受けて、APOBEC3Aを標的にした新しい治療法の開発が期待されています(Villanueva, Nat Rev Drug Discov. 2023)。
当研究分野では、APOBEC3A阻害剤の開発やクローン進化機構のさらなる解明を通じて、発がんや薬剤耐性を予防する新しい治療法の構築を目指しています。また、ゲノム編集技術を活用した治療法の開発にも取り組んでおり、がん治療における新たな可能性を切り拓くことを目指しています。
1. がん患者由来モデルの作成
Patient derived xenograft mouse model(PDX)、Patient derived cell line mode (PDC)、Organoid
2. がんクローン進化機構の解明による予防的治療の確立
APOBEC3Aを標的とした核酸医療の開発
APOBEC3A発現制御機構の解明およびバイオマーカーの探索
がんクローン進化機構の解明
3. 遺伝子編集技術を用いた新規治療法の開発
Prime editorを用いた治療標的スクリーニング


