組織・研究分野
がん微小環境研究プログラム
Cancer Microenvironment Research Program
免疫環境ダイナミクス研究分野
Division of Immune Environment Dynamics
スタッフ

教授
岡本 一男
Okamoto Kazuo

助教
田辺 和
Tanabe Yamato
目的と研究課題
免疫系は、病原菌などの異物を非自己と認識し排除する生体防御システムです。一方がんでは、がん細胞由来の変異タンパク質などが非自己と認識され免疫系の攻撃対象となります。しかし、腫瘍周囲で免疫抑制が誘導されたり、免疫原性が低くなるなどして、腫瘍は免疫系による攻撃から逃れるようになります。本研究室では、腫瘍組織内の免疫細胞、がん細胞、そして様々な間葉系細胞との複雑な細胞間相互作用を紐解くことで、腫瘍特有の免疫環境を分子レベルで理解することに取り組んでいます。免疫系を軸とした異種細胞間ネットワークを切り口に、腫瘍の免疫環境をコントロールすることで、がんの予防・治療戦略の創成を目指しています。
【がん骨転移の発症機構の解明と治療開発に向けて】
骨転移は運動機能低下に直結する予後不良因子であり、根治療法の開発は重要な課題です。私共は骨由来のサイトカインRANKLの可溶型が、乳がんや悪性黒色腫の骨転移を誘導することを発見し (Asano, Okamoto et al, Nature Metab, 2019)、新規RANKL低分子阻害剤が骨転移を抑制することを報告してきました (Nakai, Okamoto et al, Bone Res, 2019)。一方、骨髄は成体造血の場であり、免疫細胞の源となる臓器です。骨髄造血環境は血球系、間葉系、血管系など多様な細胞集団から構成され、綿密な細胞間ネットワークにより制御されています。しかし骨転移では無秩序な腫瘍の進展により、骨構造・骨髄環境は大きく変容します。骨髄の構成細胞と免疫細胞との相互連関に着目し、骨転移巣の腫瘍微小環境を理解することで、腫瘍進展を阻害する新規がん療法の開発に繋がるような、創薬ターゲットの創出を目指しています。
【T細胞を中心とした免疫制御の分子基盤研究】
自己免疫疾患などの慢性炎症の原因となるTh17細胞の分化・維持機構や、T細胞と組織構成細胞との相互作用に基づく組織炎症、修復機構を明らかにしてきました (Okamoto et al, Nature, 2010; Inoue, Okamoto et al, Nature Immunol, 2018)。T細胞応答制御の分子基盤を解明することで、抗腫瘍免疫の効率的な誘導法の開発に繋げます。
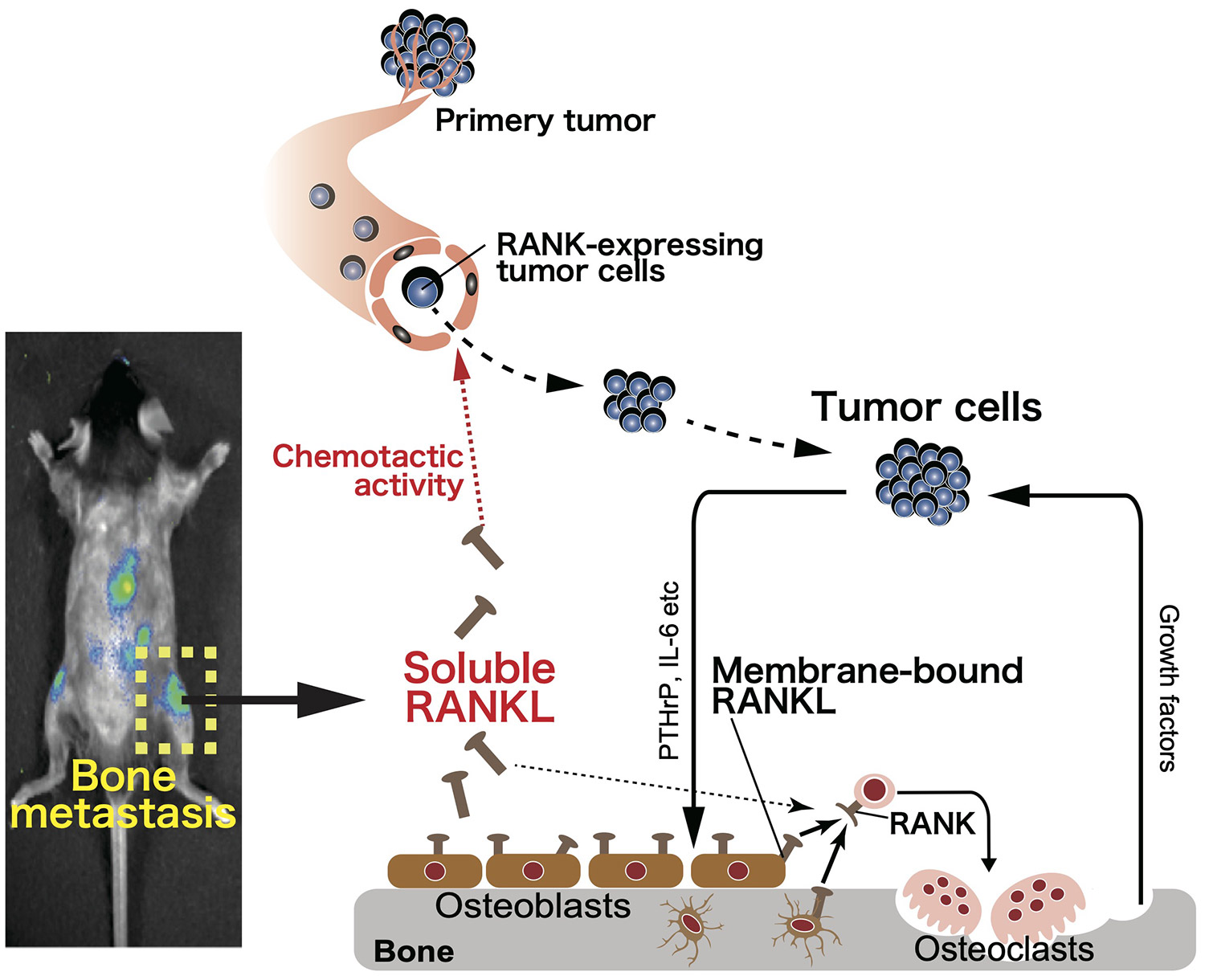
図1 可溶型RANKLはがん細胞に直接作用し、骨への走化性を促すことで骨転移を誘導する
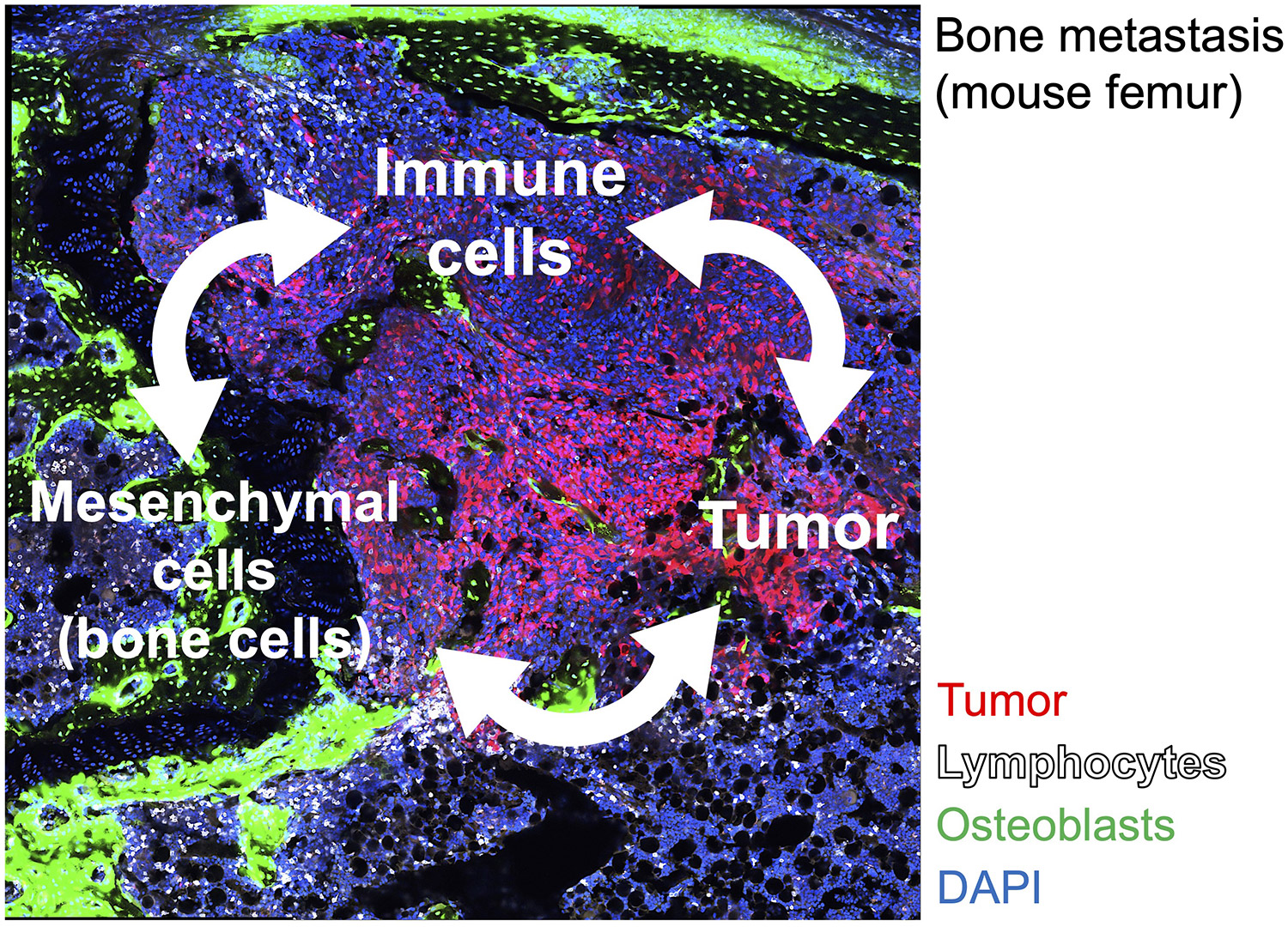
図2 がん、免疫細胞、間葉系細胞 (骨構成細胞など)からなる腫瘍微小環境の理解


