組織・研究分野
がん幹細胞プログラム
Cancer and Stem Cell Research Program
腫瘍分子生物学研究分野
Division of Oncology and Molecular Biology
スタッフ

教授
髙橋 智聡
Takahashi Chiaki

助教
河野 晋
Kohno Susumu

特任助教
中山 淨二
Nakayama Joji
2020 ver. 腫瘍分子生物学 概要
ほぼすべてのがん化シグナルは、RB1がん抑制遺伝子がコードするタンパク質の働きにブレーキをかけることによって異常な細胞周期進行を促進します(図1)。また、RB1そのものの機能が喪失することによってもがんが生じたり悪性化したりします(図2)。我々は、RB1の機能が抑制された時に起こる様々な現象(未分化性亢進、治療耐性獲得など)の分子機構を詳細に調べることによって、がんの悪性進展に対抗する方法を研究してきました。その結果、RB1がまだ使えるがんともう使えなくなったがんに分けて治療法を考えるとよいという考えを持つに至りました。
RB1機能を保持しているがんの攻略
ほぼすべてのがん化シグナルは、D型サイクリンの発現を亢進することによってサイクリン依存性キナーゼ(CDK)群の働きを強め、RB1のモノリン酸化を誘導、これが、14箇所のリン酸化によるRB1の機能喪失の引き金となります。これまで使用されてきた分子標的薬(イレッサ、グリベック、トラメチニブなど)は、がん化シグナルを途中でブロックするものです。我々が今注目しているのは、CDK4とCDK6の活性を同時に阻害する薬剤です。これは、RB1のモノリン酸化を阻害することによって、RB1のがん抑制機能を取り戻させます。つまり、がん化シグナルの終着点を切ることによってがんを治療するやり方です。進行性のホルモン依存性乳がんに対し保険適用が認められていて、ホルモンの働きを弱める薬と併用することによって無病生存期間(DFS)を2倍に延長するなどの効果が見られています。我々は、CDK4/6阻害剤の適用拡大を念頭に、本剤効果の詳細な分子機序と内因性の耐性機序を解明しようとしています。
RB1機能を喪失したがんの攻略
これは20年以上かけて研究してきました。RB1機能を喪失することによって、細胞周期進行が促進するだけでなく、Rasがん化シグナルが増強されることや、細胞内代謝(解糖系、脂質合成系)や腫瘍微小環境の改編が起こり、がん細胞の生存戦略が強化されることを明らかにしました。これまでに見つけたRB1標的分子のいくつかを新規治療標的としてインキュベートしております。最近、RB1機能喪失と合成致死性を示すAurora A/B、CHK1、PLK1などの分子にも注目しています。また、RB1遺伝子欠失を含むゲノム異常に巻き込まれることによって欠失するSUCLA2という代謝遺伝子にも着目しています。SUCLA2を欠失した進行前立腺がんを治療する薬剤を開発しています。
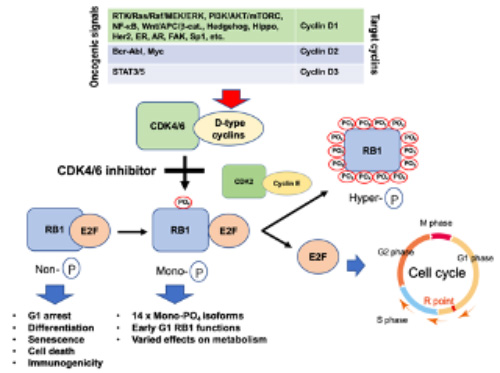
図1
ほぼすべてのがん化シグナルはRB1機能にブレーキをかける。
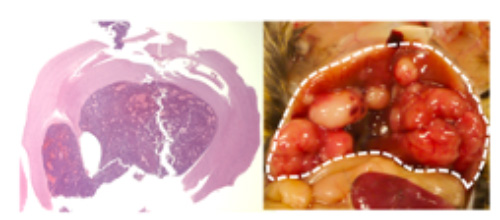
図2
RB1機能を抑えることによって生じた脳腫瘍(左)と肝臓がん(右)。


