ニュースレター
News Letter
News Letter Vol.19
目次
- 所長よりご挨拶
- シンポジウム・研究会の開催
- 共同研究者の紹介
九州大学生体防御医学研究所 野島 孝之 准教授
金沢大学がん進展制御研究所 鈴木 健之 教授 - 令和5 年度 共同研究採択課題一覧
- がん進展制御研究所外国人研究者の紹介
腫瘍分子生物学研究分野 Santosh K. Gothwal 特任助教 - 高校生のためのがん研究早期体験プログラム
『がん研EEP2023』 - 高校生へ向けて研究紹介
遺伝子染色体構築研究分野 平尾 敦 教授 - これまでに開催したセミナー/ 業績など
- 少し足を延ばして、石川の歴史探訪
所長よりご挨拶
金沢大学がん進展制御研究所
所長 鈴木 健之
 本年4月より、金沢大学がん進展制御研究所所長を拝命しました鈴木健之と申します。本研究所は、国立大学附置研究所の中で唯一の「がん研究」に特化した研究所として、1967年に設置されました。以来、「がんに関する学理及びその応用の研究」に焦点をあて、がんの本態解明を目指す基礎研究とそれを応用した臨床研究を一体的に推進してきました。これまでの本研究所の研究活動や共同研究拠点活動を継承し、がん研究コミュニティの発展に貢献できますよう取り組んで参りたいと存じます。何卒よろしくお願い申し上げます。
本年4月より、金沢大学がん進展制御研究所所長を拝命しました鈴木健之と申します。本研究所は、国立大学附置研究所の中で唯一の「がん研究」に特化した研究所として、1967年に設置されました。以来、「がんに関する学理及びその応用の研究」に焦点をあて、がんの本態解明を目指す基礎研究とそれを応用した臨床研究を一体的に推進してきました。これまでの本研究所の研究活動や共同研究拠点活動を継承し、がん研究コミュニティの発展に貢献できますよう取り組んで参りたいと存じます。何卒よろしくお願い申し上げます。
5月8日から新型コロナウイルスの感染症法上の位置づけが、季節性インフルエンザなどと同じ「5類」に移行しました。感染対策は個人の判断に委ねられ、様々なイベントの自粛要請などはなくなり、3年余り続いた組織的なコロナ対策は終わりを迎えたと考えられます。本研究所におきましても、様々なセミナーやシンポジウムなどのイベント、日常の講義や実習が予定通り対面で実施できるようになり、ほっとしているところです。一方で、感染対策のための規制の中で定着したWeb会議ツールを利用したオンライン会議は、私たちの働き方に大きな変化をもたらしたことも事実です。移動が不要になりコストが削減でき、時間を有効に使えるようになりました。以前より密な連携や共同研究が可能になった事例もあると思います。このように多様化したコミュニーケーションの利点を活かして、7月にハイブリッド形式で国際シンポジウムを開催しました。インドと日本の両国間でがん研究の交流を図る初めての国際会議であり、インドの主要な4つの研究機関(TaTa Memorial Centre, NIPER, INST and SCTIMST)、及び日本側の4つの研究機関(国立がん研究センター研究所、がん研究会がん研究所、ナノ医療イノベーションセンター、当研究所)から講演者が参加し、講演と討論がそれぞれの研究所にオンライン中継されました。本国際会議が、両国間の共同研究や研究者・学生の交流の活性化につながることを期待しています。
8月には、高校生を対象とするがん研究早期体験プログラム(がん研EEP 2023)を開催しました。これは高校生に実際の研究の現場に来てもらい、現役の研究者から研究内容やその意義に関する解説を受け、実験を見学・体験することを通して、がん研究に興味を持ってもらうプロジェクトです。今年で2年目になりますが、研究体験と授業編あわせて56名の参加がありました。参加した高校生が、アカデミア・医療・産業界において未来を切り拓く研究者へと育つことを願っています。なお、本プログラムの様子については、がん研ホームページ、ならびにがん研EEPホームぺージにて詳しく報告しております。皆様にご覧いただきたく存じます。
共同研究者の紹介
「がんRNA 転写終結の破綻に関する鈴木健之教授との共同研究」
九州大学生体防御医学研究所
腫瘍防御学分野
准教授 野島 孝之
 皆様はじめまして、九州大学生体防御医学研究所の野島孝之と申します。2022年度から金沢大学がん進展制御研究所の鈴木健之先生と共同研究をさせていただいております。このような自己紹介の機会を頂き、感謝致します。
皆様はじめまして、九州大学生体防御医学研究所の野島孝之と申します。2022年度から金沢大学がん進展制御研究所の鈴木健之先生と共同研究をさせていただいております。このような自己紹介の機会を頂き、感謝致します。
この文章は、研究会からの帰路で利用した某空港のラウンジで書いています。最近、オンサイトの学会、研究会の機会が増えてきており、コロナ感染の心配はあるものの、参加してみるとやはり現地参加は良いものだと感じます。教科書や論文に書かれている事は過去の出来事ですし、やはり最前線でご活躍されている先生方にお会いして聞く最新の研究のお話が一番ワクワクします。
思い返しますと、私が現所属に独立准教授として英国から着任したのは、2021年初めでした。当時英国では、コロナ禍のピークで、全国的にロックダウンといわれる外出や人との接触制限が行われていました。その中で、10年間過ごしたラボにひっそりとお別れをし、日本へ帰国しました。日本帰国後も、学会やセミナー、財団の贈呈式等は基本的にオンライン開催となり、何か物足りない気がしていましたし、新しい人脈を形成することが非常に困難でした。その中で、突然メールでご連絡したにも関わらず、親身にご相談に乗っていただいた鈴木健之先生には感謝しかありません。それ以来、何回もやりとりを重ねてきましが、今年の2月に金沢大学に伺う機会がありまして、やっとリアルでお会いすることができました。やはり、実際にお会いしてみると、より深く鈴木健之先生のご研究やお人柄が理解でき、金沢の美味しいお料理とお酒の助けもあって、新しいアイデアも生まれました。現在、良い共同研究成果を得られるように楽しみながら頑張っています。
私の専門は、転写やRNAプロセシングといった核内遺伝子発現機構の分子生物学的解析です。共同研究では特に、がんクロマチン環境での転写終結破綻機構に注目しています。「終わり良ければ全てよし」という言葉もある様に、転写終結は重要な遺伝子発現機構です。例えば、一部のがんでは、転写終結破綻によって新しい転写開始が行われず、遺伝子発現が低下することがわかっています。また、タンデムに遺伝子が並んでいる場合、転写終結破綻は、下流の遺伝子産物とキメラRNAを産生させます。さらには、遺伝子間領域においてDNA損傷を誘起することも知られています。しかしながら、がんと転写終結の関わりは、まだわかっていないことが多く残されています。鈴木健之先生をはじめとする金沢大学の先生方にご指導いただき、がんゲノムの作動機構の解明に少しでも多く貢献できればと存じます。今後とも何卒よろしくお願い申し上げます。
がんクロマチン環境と転写制御異常
金沢大学がん進展制御研究所
機能ゲノミクス研究分野
教授 鈴木 健之
私たちの研究室では、ウイルス挿入変異法によるがん関連遺伝子の同定とその遺伝子産物の機能解析をテーマに研究しています。レトロウイルス感染発がんモデルマウスでは、ウイルスがゲノムに挿入し、遺伝子変異や周辺遺伝子の発現異常によってがんを誘発するため、ウイルス挿入部位を解析することによって原因遺伝子を容易に同定することができます。このスクリーニングで、ヒストンのメチル化修飾酵素などエピジェネティック制御因子をコードする遺伝子が高頻度に単離されたことから、がん悪性進展におけるエピジェネティクス制御に焦点を当てた現在の主要な研究課題がスタートしました。挿入変異の標的には、タンパク質をコードする遺伝子だけでなく、マイクロRNAや長鎖非コードRNAも含まれており、それらも研究対象になっています。
野島孝之先生との共同研究は1通のEmailから始まりました。私たちの挿入変異がん遺伝子スクリーニングに興味を持たれた先生から連絡を頂戴し、すぐにZoomミーティングを設定したのを覚えています。野島先生は、転写の網羅的プロファイルとその制御機構を解析するために、転写装置から合成されたばかりのRNA(新生RNA)を解析する方法(mNET-seq法、POINT法)を開発された新進気鋭の若手研究者です。がん細胞で起きているクロマチンと転写状態の変化、特に非コードゲノム領域の転写の脱制御に興味を持たれていて、<がんクロマチン環境における非コードRNA産生機構の解明>を課題として共同研究を進めています。野島先生は10年にわたる英国での研究生活でユニークな転写産物解析技術を次々に開発され、CellやMolecular Cellなど超一流国際誌に多くの研究成果を発表されました。本共同研究におきましても、次々に湧き出てくる新しいアイデアをもとに問題点を解決し、課題をさらに発展させていく現場を共有できますことを大変ありがたく思っています。独自性の高い新生RNA解析法を用いて、がん特異的なクロマチン環境と転写終結破綻をはじめとする転写制御異常のメカニズムを解明し、新しい治療標的の開発につながる共同研究に発展させたいと考えています。

がん進展制御研究所外国人研究者の紹介
“Nothing in biology makes sense except in the light of evolution.” by Theodosius Dobzhansky
腫瘍分子生物学研究分野
特任助教 Santosh Kumar Gothwal
 The universe is an endless expansion of physical matters and energy, where combinations of these drove biological creatures. One of remarkable things which humans have been able to decode is to capture the series of chemical reactions that have occurred over millions of years, leading to the synthesis of DNA, the genetic material. As humans on planet Earth, we consider ourselves the most powerful and intelligent biological creatures, but this notion lacks mutual cross-phylum agreements. A good parameter of intelligence can be level of genomic stabilities within organism’s, which safeguard against the onset of diseases and cancer.
The universe is an endless expansion of physical matters and energy, where combinations of these drove biological creatures. One of remarkable things which humans have been able to decode is to capture the series of chemical reactions that have occurred over millions of years, leading to the synthesis of DNA, the genetic material. As humans on planet Earth, we consider ourselves the most powerful and intelligent biological creatures, but this notion lacks mutual cross-phylum agreements. A good parameter of intelligence can be level of genomic stabilities within organism’s, which safeguard against the onset of diseases and cancer.
In biology, the inheritance of DNA is of utmost importance because mutations in somatic cells are not inheritable. This notion is signified due to the fact that most accurate mode of DNA repair, known as homologous recombination (HR), which utilizes a homologous DNA template as a repair substrate, becomes a compulsory mode of DNA break repair in germ cells, while error-prone pathways like NHEJ (non-homologous end joining) are strongly suppressed. During my studies at Osaka University under the guidance of Professor Akira Shinohara, I had the privilege of studying such phenomena, specifically focusing on the role of an epigenetic factor called Paf1C. The Paf1C determines the sites of DNA breaks on meiotic chromosomes and establishes a landscape for homologous recombination, ensuring safe genome inheritance. This strict monitoring of germline DNA protection, while allowing for allelic variation, forms the basis of safer genetic inheritance and genome evolution. On the other hand, error-prone pathways dominate in somatic cells, and their accumulative actions over the selection process is reflected in the formation of cancer. This emphasizes the significance of genome stability and why this is prioritized in the germ cells.
Many labs are working tirelessly to somehow achieve synthetic lethal combinations for cancer therapeutic development. However, a major concern lies in the in-depth understanding of principles of outcomes of chemotherapeutic induced genomic instabilities, which often induce cancer cell heterogeneity. Currently, there are no measures to prevent such heterogeneity, and evidence bringing synthetic lethality in early clinical trials are easily turning into new “key scientific question” for grant proposals. This necessitates thorough contemplation on the fundamentals of genetics and the importance of genome stability in cancer chemotherapeutic developments.
Having spent the last 12 years in Japan, starting as a doctoral student in Osaka and as a Postdoctoral Fellow with Professor Tasuku Honjo at Kyoto University, I have studied genetic and somatic recombination systems, which have taught me the essence of genome integrity. Here at Cancer Research Institute, I see inspiring research being carried in every lab, giving me a chance to learn new insights. In Kanazawa, I aim is to develop my research direction that integrates epigenetic and genome stability principles in cancer research. This is a tough route and I hope I can make it being among the scientists at CRI.
I came from the Jaipur ‘the pink city’ of India. Jaipur is very historic, beautiful and heritage city. I chose Japan for my studies due to my childhood impression, i.e. Japan’s remarkable progress after World War II and its ability to deliver cutting-edge advancements in science and technology. I hope that my decision to pursue scientific career in Japan will be proven right. My hobby is playing cricket and chess. I live in Kanazawa with my wife and 2 sons, both were born here in Japan. We like the nature and peace of this city and Ishikawa prefecture. I am thankful to this beautiful country in many ways.
高校生へ向けて研究紹介
さあ、幹細胞を集めてみましょう!
遺伝子染色体構築研究分野
教授 平尾 敦
血液の幹細胞の役割とその異常
私たちの体の中では、白血球や赤血球、血小板など、様々な血液細胞が体を守るために日々活躍しています。これらの血液細胞は、骨髄(大きな骨の髄)の中にほんのわずかしか存在しない特殊な細胞である造血幹細胞から生まれます(図1)。造血幹細胞は、個体の一生にわたって、血液細胞の源の細胞としての役割を果たしており、そのために様々な仕組みが備わっています。この仕組みが崩れると、血液細胞がうまく産生されなくなったり、異常な細胞が増えたりすることがあります。場合によっては、白血病のような「血液のがん」の原因となることもあります。私たちは、造血幹細胞がどのように生まれるのか、また、その異常が白血病の発生にどのように関わるのか、さらには、どのように治療できるのか、研究を行っています。
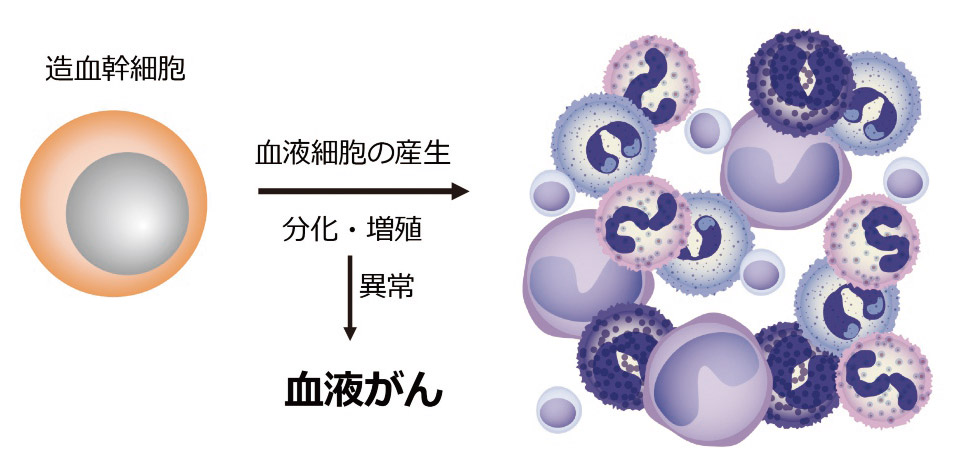
図1 血液細胞の源としての造血幹細胞
造血幹細胞の老化は、全身の老化につながる!
最近の研究では、造血幹細胞の「老化」が注目されています。この老化の原因は、年をとるにつれて幹細胞内で自然に起こる「遺伝子の変異」です。このような異常な幹細胞から生まれた血液細胞は、炎症性サイトカインという物質を大量に産生し、血管の動脈硬化を引き起こします。その結果、心筋梗塞や慢性肝臓病、さらにはアルツハイマー病(認知症)の発症頻度が上昇するなど、驚くべきデータが次々と明らかになっています。このように、造血幹細胞の異常は、加齢に伴う様々な病気の原因となり、個体の老化を促進することが分かってきました(図2)。私たちは、造血幹細胞の観点から、どのように老化を防ぎ、年をとっても健康を維持・増進できるのかを解明したいと考えています。
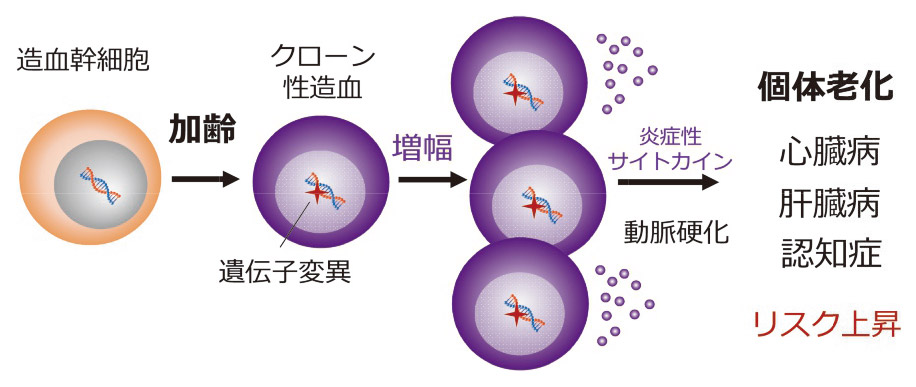
図2 加齢に伴う造血幹細胞の異常と個体老化
さあ、幹細胞を集めてみましょう!
造血幹細胞を研究するためには、他の血液細胞と区別し、集める必要があります。しかし、造血幹細胞は、骨髄の中でもごくわずかしか存在しません。見た目もリンパ球と区別することができません。そのため、細胞表面にある特定のタンパク質を目印にし、特殊な装置(フローサイトメーター)を使って生きたまま幹細胞を集めます。毎年夏に開催される高校生を対象としたがん研究体験(がん研EEP)では、実際にマウスの骨髄から血液細胞を取り出し、フローサイトメーターを使って幹細胞を集める実習を行っています(下図)。このような活動を通じて、高校生の皆さんに研究の面白さや楽しさを体験してもらいたいと思っています。





