ニュースレター
News Letter
News Letter Vol.20
所長よりご挨拶
金沢大学がん進展制御研究所
所長 鈴木 健之
 本年1月1日に発生した令和6年能登半島地震は、石川県を中心に甚大な被害をもたらしました。多くの尊い命が犠牲になり、被災された多くの方々は現在もなお不自由な生活を余儀なくされています。私たち金沢大学がん進展制御研究所も地震の被害を受け、一部で建物(天井や壁)の損壊などがありましたが、幸いにも研究所の構成員は皆、無事が確認されています。転倒や落下による研究機器の破損なども発生しましたが、研究活動への影響は限定的なものでした。これまで多くの国内外の研究者の方々から、お見舞いやご支援のお申し出などをいただきました。温かいお心遣いに対しまして心よりお礼を申し上げます。研究所一丸となって、共同研究拠点活動を通したがん研究コミュニティの一層の発展に努めるとともに、被災地の復興に少しでも貢献できるよう取り組んで参りたいと決意を新たにしているところでございます。今後とも引き続き、ご支援ご協力を賜りますようよろしくお願い申し上げます。
本年1月1日に発生した令和6年能登半島地震は、石川県を中心に甚大な被害をもたらしました。多くの尊い命が犠牲になり、被災された多くの方々は現在もなお不自由な生活を余儀なくされています。私たち金沢大学がん進展制御研究所も地震の被害を受け、一部で建物(天井や壁)の損壊などがありましたが、幸いにも研究所の構成員は皆、無事が確認されています。転倒や落下による研究機器の破損なども発生しましたが、研究活動への影響は限定的なものでした。これまで多くの国内外の研究者の方々から、お見舞いやご支援のお申し出などをいただきました。温かいお心遣いに対しまして心よりお礼を申し上げます。研究所一丸となって、共同研究拠点活動を通したがん研究コミュニティの一層の発展に努めるとともに、被災地の復興に少しでも貢献できるよう取り組んで参りたいと決意を新たにしているところでございます。今後とも引き続き、ご支援ご協力を賜りますようよろしくお願い申し上げます。
さて皆様にお伝えしたい研究所にとって嬉しいお知らせがひとつございます。本研究所は、今年度、学際領域展開ハブ形成プログラム(文部科学省 共同利用・共同研究システム形成事業)に採択され、『健康寿命の延伸に向けた集合知プラットフォームの形成』プロジェクトをスタートすることができました。本プロジェクトにご参画いただきました東北大学加齢医学研究所、大阪大学微生物病研究所、慶應義塾大学先端生命科学研究所の先生方、関係者の方々に厚くお礼申し上げます。
人生100年時代を迎えた現代において、健康寿命を延伸することは、個人の幸福や社会の持続可能性にとって大変重要な課題です。そのためには、単一の学術研究領域を極めるだけでは十分とは言えず、領域を超えた新しい学際領域の開拓が求められています。本プロジェクトでは、「がん」「老化」「炎症」「代謝」に関する研究に卓越した実績を有する研究所が集結し、研究者間の共同研究にとどまらない組織レベルの機動的な連携・協働を拡充することによって、学際研究領域「健康寿命科学」コンソーシアムを形成する計画です。それぞれの研究機関が従来対象としてきた研究分野や研究者コミュニティの枠を超え、国内外の様々な分野の研究者が参画可能な<ハブ>を形成することによって、共同利用・共同研究活動を活性化させ、健康寿命の延伸に向けた<集合知>プラットフォームの構築を目指しています。この2月に、本プロジェクトの始動を祝ってキックオフシンポジウムを金沢で開催いたしました。連携する4つの研究所から講演者や共同研究者が参加し、最先端の「健康寿命科学」研究に関して活発な議論を交わすことができました。今回のシンポジウムが、様々な研究分野を専門とする研究者が交流を深めお互いの研究を理解し、新しい学際的融合研究をスタートする良い機会になることを願っています。
最新トピックス
文部科学省 共同利用・共同研究システム形成事業
学際領域展開ハブ形成プログラムに採択!
『事業名:健康寿命の延伸に向けた集合知プラットフォームの形成』
令和5年度に文部科学省より公募のありました、共同利用・共同研究システム形成事業 学際領域展開ハブ形成プログラムに本研究所が申請し、採択されました。
連携する4つの研究所は、「がん」「老化」「炎症」「代謝」研究に卓越した実績を有しており、それぞれの研究分野で共同研究を積極的に展開してきました。本事業では、これらの研究所が協働することによって、従来の研究領域や研究者コミュニティの枠を超えて、様々な学問分野の研究者が参画できる<ハブ>を形成し、新しい学際領域「健康寿命科学」を切り拓きます。学術研究の発展や国際連携の強化、健康寿命の延伸に向けた社会実装、健康社会の形成に貢献することを目指します。
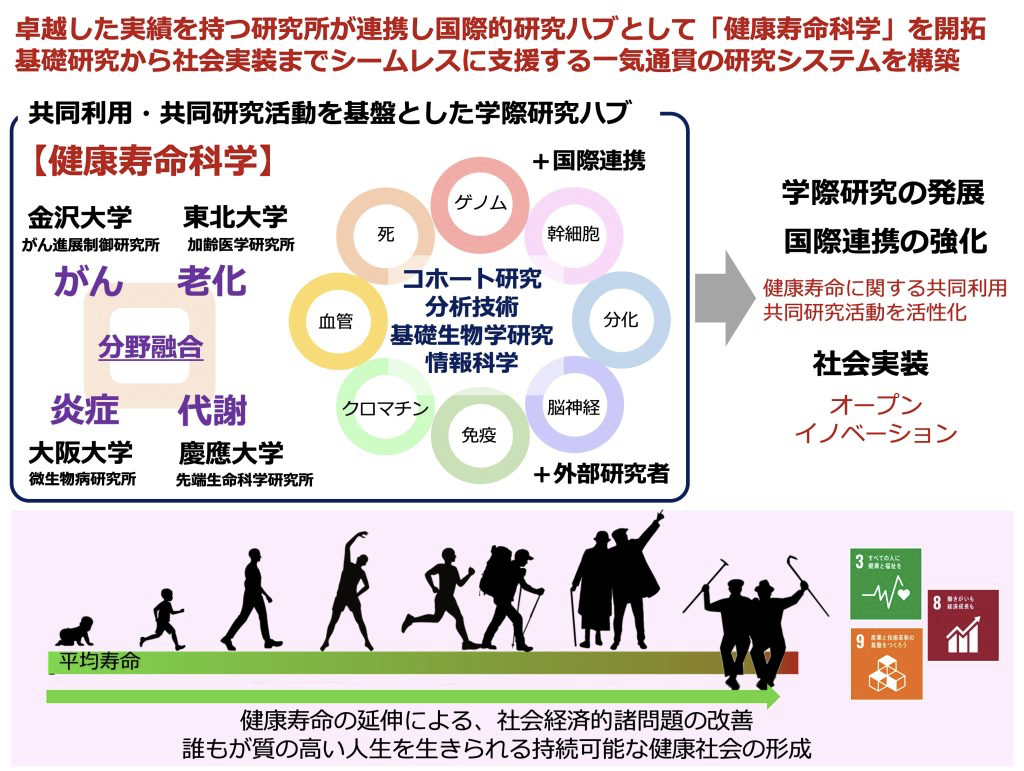
【申請機関】金沢大学がん進展制御研究所
【参画機関】東北大学加齢医学研究所・大阪大学微生物病研究所・慶応義塾大学先端生命科学研究所
【参考】文部科学省 共同利用・共同研究システム形成事業ホームページ
金沢大学がん進展制御研究所学際領域展開ハブ形成プログラムホームページ
定年退任のご挨拶
源利成教授は2024年3月末をもって、当研究所を定年でご退任されました。2001年7月に金沢大学教授に就任され、24年の長きにわたり、消化器がんと難治性がんを主な対象とし、それらの多様な分子細胞学的特性の解明を基に、がんの診断や治療法の開発研究を展開されるとともに、外科医として消化器がんの診療に携わりながら、若手研究者や臨床医の育成にも尽力されてきました。その永年にわたる功績に心より敬意と感謝を申し上げます。
これまでといま、そしてこれから
腫瘍制御研究分野
源 利成 教授
 2024年3月末が私の退職予定であることから、本誌への寄稿依頼が届きました。せっかくの機会なので、これまでといま、そしてこれからのことについて認(したた)めます。
2024年3月末が私の退職予定であることから、本誌への寄稿依頼が届きました。せっかくの機会なので、これまでといま、そしてこれからのことについて認(したた)めます。
私は順天堂大学医学部卒業後すぐに、本学大学院で病理学を修めました。その在籍中2年間の東京医科歯科大学難治疾患研究所への出向を経て、浸潤性乳管がんとびまん型胃がんの硬性間質(腫瘍環境)の病態について病理学と生化学の融合研究を纏めました。学位研究後は2008年まで金沢大学がん研究所と附属病院(写真2 / 2001年10月に米泉町から金沢大学病院に統合)で消化器・腫瘍外科の修練と研究に従事しました。途中、国立がんセンター研究所と米国マントサイナイ医科大学に出向した期間のほかは、15年間に400人以上の患者さんを執刀する機会に恵まれました(写真1 / 中央が自分)。1998年春から現研究分野の併任を始めたので、2008年7月のがん研外科診療科の廃止までの10年間は外科、外科病理診断とがん研究の掛けもちでした。それ以降は現在まで、消化器がんや難治・希少がんの橋渡し研究に軸足を移し、大学病院がんセンターで診療を続けています。
外科の恩師(写真1 / 右から2人目:磨伊正義氏、故人)からは次のような教えを受けました。それは「手術は知識、技量、経験を遺憾なく発揮すべき場であり、外科医を志す医師がその習熟と向上に努力すべきことは言うまでもない。日常診療で外科医が患者さんを診察し、手術し、社会復帰させるまでの一連の過程には、患者さんと医師との信頼関係が最も重要であり、単に手術を行うという技術的な面だけでなく、外科医としての情熱と人間性が要求される。」というものです。
また、研究が少し軌道に乗りかけた2005年頃、米国研究者や米国癌学会とトラブルがあったとき、国立がんセンターの恩師(故:杉村 隆氏)から、次のような手紙が届きました。
その内容は「国際的 -international- ということは、各国の歴史、文化が確認されて成り立っている美名です。中性の水のようなものではなく、国際化という言葉は商売の駆け引きや民族の勢力争いのとき、最もしばしば使われます。パスツールが云った科学には国境がなくとも、科学者には国境がある、ということです。日本人は人が好いので、結局、西洋人に手玉にとられるのです。西洋にはない仕事を早くして、早く発表することが唯一無二の方策です。元気を出して、日本の科学のためにご健闘ください。」という、叱責と激励です。これまでの仕事とこれらの助言を踏まえ、臨床力と研究力に関する自身の考えを駄文にまとめました1)。ご関心があれば、私か十全医学会編集部、あるいは当研究所共同利用・共同研究拠点推進室に電子版別刷りをご請求ください。
人生のおよそ3分の2におよぶ期間、病理(学)、外科(学)、研究ともに大講座ではなく、一貫して小さなグループで活動してきました。それでも多くのかけがえのない仲間に出会い、いただいた公的・民間の研究資金は9億円に迫ろうとしています2)。ありがたいことと、国民や仲間のみなさんに感謝しながら、大学を離れてこれからどこでどうしようかと思案しています。
(寄稿:2024年2月)
1)源 利成 巻頭言:研究力と臨床力
Integrative biomedical research and clinical activity.
金沢大学十全医会誌 124 (2): 19, 2015.
別刷請求先:minamoto@staff.kanazawa-u.ac.jp
kyoten@adm.Kanazawa-u.ac.jp
2)金沢大学がん研腫瘍制御研究分野ホームページ:
http://ganken.cri.Kanazawa-u.ac.jp/shuyoseigyo/
写真1:筆者中央

写真2:旧金沢大学がん研究所附属病院 米泉町
松本邦夫教授は2024年3月末をもって、当研究所を定年で退任されました。2007年に金沢大学教授、2021年当研究所所長、2022年に金沢大学副学長(産学連携・研究(総括))に就任され、17年にわたり本学の研究および教育に多大な貢献をされました。特に、研究においては肝細胞増殖因子(HGF)を中心に、卓越した研究成果を挙げるとともに、HGFの医薬品開発にも精力的に取り組んでこられました。永年にわたり多くのご功績を残されましたことに敬意を表しますとともに、本研究所の発展に貢献されたましたことに心より感謝申し上げます。
がん進展制御研究所での切磋琢磨
腫瘍動態制御研究分野
松本 邦夫 教授
 私は2007年4月、がん進展制御研究所に着任し、本年3月に定年退職しました。がん進展制御研究所、学生時代の憧れの研究施設で、錚々たる研究が発信されてきた研究所です。それゆえに、自身がその研究所で研究を進められることは誇りである一方、終始、大きな責任・使命を感じながら仕事をしてきました。
私は2007年4月、がん進展制御研究所に着任し、本年3月に定年退職しました。がん進展制御研究所、学生時代の憧れの研究施設で、錚々たる研究が発信されてきた研究所です。それゆえに、自身がその研究所で研究を進められることは誇りである一方、終始、大きな責任・使命を感じながら仕事をしてきました。
私はHGF(肝細胞増殖因子)の研究を中心に進めましたが、とりわけ専門の異なる研究者と研究を共にする経験は貴重でした。2013年、環状ペプチド創薬の世界を切り開かれた東京大学の菅裕明先生とのご縁をいただきました。化学合成による人工増殖因子創成(2015〜2018年)、HGFを特異結合・阻害する環状ペプチドによるイメージング診断(2019〜2023年)、環状ペプチドを基盤とするlasso-graft分子技術(菅先生と大阪大学の高木淳一先生が確立)によるMET活性化分子創成(2021〜2023年)など、大興奮の結果が継続的に得られ、研究の飛躍につながりました。2015年、新設の新学術創成研究機構で仕事をする機会をいただきました。2017年、高速原子間力顕微鏡(AFM)による分子計測を中核とするナノ生命科学研究所(NanoLSI)がWPI拠点(世界トップレベル研究拠点プログラム)に認定され、同研究所のPIとして仕事をする機会にも恵まれました。私の専門は生化学です。タンパク質の発現・精製に習熟していましたので、高速AFMとの相性は抜群でした。HGFやMET受容体分子がリアルに動く様子が高速AFMで“見えた”時には、声を上げて興奮しました。高速AFMとの分野融合は飛躍を後押ししました。
私は、2001年にバイオベンチャーとしてクリングルファーマ株式会社を起業しました。実は倒産の危機が数回ありましたが、2019年に臨床試験の結果がオープンになり、同社は2020年、東証マザーズへの株式上場に至りました。脊髄損傷など、安全で有効な治療手段のない疾患に苦しむ患者さんに、HGFを有用な医薬として役立たせるという宿願の達成に大きく近づきました。クリングルファーマ社で、夢を共有し、結束し、危機を乗り越えた同社の皆さんの情熱の賜物です。
がん進展制御研究所での17年間は、まさに切磋琢磨の日々でした。一緒に研究を進めていただいた腫瘍動態制御研究分野のみなさん、研究所のスタッフの皆さん、事務のみなさんとも一緒に仕事をさせていただきました。皆様とご縁をいただけたことに感謝しています。ありがとうございます。
[経歴]
1981年 金沢大学理学部生物学科卒業
1986年 大阪大学理学研究科博士後期課程修了(理学博士)
1986年 大阪大学医学部皮膚科 助手
1990年 九州大学理学部生物学教室 助手
1993年 大阪大学医学部バイオメディカルセンター助手
1996年 大阪大学医学系研究科 准教授
1998年 米国 Brown 大学 Visiting Associate Professor(10ヶ月)
2007年 金沢大学がん進展制御研究所 教授
2017年 ナノ生命科学研究所 教授(併任)
2021年 金沢大学がん進展制御研究所 所長
2022年 金沢大学副学長(産学連携・研究(総括))
[受賞]
1991年 日本産業衛生皮膚協会研究奨励賞
2006年 Nature Medicine-AnGesMG BioMedical Award 大賞
1997年 日本癌学会奨励賞
2014年 文部科学大臣表彰 科学技術賞
2002年 第3回バイオビジネスコンペ JAPAN 審査員特別賞
2022年 金沢市文化賞など

研究室メンバー(筆者一番左)

研究室メンバー(筆者後列中央)
新企画 注目の研究
研究の新しい展開 共同研究に支えられて
金沢大学がん進展制御研究所
腫瘍動態制御研究分野
准教授 酒井 克也
 子供の頃、蝉やとんぽ、蝶々を捕まえ、魚や動物の図鑑を眺めることが大好きでした。「学研の科学」シリーズに夢中になり、その影響からか大学進学時には科学者になりたいと考えていました。大学4年生の時、中内啓光先生に出会い、修士課程でお世話になった仲野徹先生の研究に触れる中で、血液幹細胞の自己複製と分化に興味を抱きました。その後バイエル薬品の研究所で創薬研究に携わりました。研究所の閉鎖に伴って、面白い基礎研究がしたいという思いがあり、大学に戻ることを考えていた時、研究室の面接でお会いしたのが松本邦夫先生で、大学に戻る決断を後押ししていただきました。現在は創薬に近い研究をしていますが、これが私の性に合っていたのかもしれません。
子供の頃、蝉やとんぽ、蝶々を捕まえ、魚や動物の図鑑を眺めることが大好きでした。「学研の科学」シリーズに夢中になり、その影響からか大学進学時には科学者になりたいと考えていました。大学4年生の時、中内啓光先生に出会い、修士課程でお世話になった仲野徹先生の研究に触れる中で、血液幹細胞の自己複製と分化に興味を抱きました。その後バイエル薬品の研究所で創薬研究に携わりました。研究所の閉鎖に伴って、面白い基礎研究がしたいという思いがあり、大学に戻ることを考えていた時、研究室の面接でお会いしたのが松本邦夫先生で、大学に戻る決断を後押ししていただきました。現在は創薬に近い研究をしていますが、これが私の性に合っていたのかもしれません。
私たちは、肝臓の再生において重要な役割を果たす肝細胞増殖因子(Hepatocyte growth factor; HGF)とその受容体Metを研究しています。Met受容体は一回膜貫通型のチロシンキナーゼ受容体で、HGFによって2つのMet受容体が相互に近づき、それにより細胞内キナーゼドメインがリン酸化されて活性化します。Met受容体は肝細胞だけでなく、腎臓や他の上皮細胞、神経細胞の再生にも関与しており、これが様々な臓器や組織の再生を促進する可能性があります。たとえば、臨床試験ではHGFタンパク質の髄腔内投与が脊椎損傷の改善に成功し、医薬品としての開発が試みられています。
2013年に始まった菅裕明先生との共同研究は、Met受容体に高い親和性で結合する大環状ペプチドがHGFの結合を阻害する可能性を検討するためにスタートしたのですが、阻害活性が無いのならペプチドを2つ繋いだら受容体を活性化できないか?という発想から、思いがけずHGFと同等にMet受容体を活性化できることが分かりました1)。ペプチドがMet受容体を活性化する可能性や、HGFと同等の作用を示す可能性については、初めは考えていませんでした。
ペプチド合成は専門的で時間がかかるので、バイオロジストはケミストに頼る必要があります。一方、バイオロジストにとって組換えタンパク質にアミノ酸を追加することは容易ですが、余分なアミノ酸を組み込むことは難しいと報告されています。1つのアミノ酸の変異がタンパク質機能に影響を与えることからも、これは理解できます。これに反して、大環状ペプチドは、タンパク質の2次構造を繋ぐへアピン/ループ部位に機能を保ったまま移植できることが高木淳一先生らの研究で明らかになりました2)。
例えば、抗体のFc断片には大環状ペプチドを挿入できるループが複数存在します(図1左)。
Met受容体やPlexinB1受容体に結合する大環状ペプチドを特定のループに挿入して2つ提示することで、受容体を様々なレベルで活性化または阻害することが可能です(図1中央、右)3),4)。おそらく様々な配置で受容体の2量体を誘導できるためと考えられます。創薬の観点では、ペプチド挿入に使用したFcの血中半減期が長いことが重要です。この手法で作成した「HGF模倣体」は、単回投与で2週間ほど有効な血中濃度を維持でき、肝硬変などの慢性疾患の治療に有望であると期待しています(図2)4)。さらに、血液脳関門(Blood-Brain Barrier: BBB)を通過する抗トランスフェリン受容体(TfR)抗体のFcループへのMet結合ペプチド挿入によって作成した「HGF模倣体」は、末梢単回投与によってBBBを通過して脳実質に到達します(図2)4)。この手法で作成した神経栄養因子模倣体は、中枢神経疾患の治療に役立つと期待されます。
論文では膨大なデータが必要とされ、一人での研究はますます厳しいものになってきています。これまで研究室の皆様、そして共同研究者の知識やアイデア、情熱に支えられてきたことを感じています。これからも皆様と力を合わせて、新たな研究成果を生み出していければと考えています。

1)Ito, et al., Artificial human Met agonists based on macrocycle scaffolds. Nat Commun. 6,6373(2015)
2)Mihara, et al., Lasso-grafting of macrocyclic peptide pharmacophores yields multi-functional proteins. Nat Commun. 12,1543(2021)
3)Sugano-Nakamura, et al., De novo Fc-based receptor dimerizers differentially modulate PlexinB1 function. Structure 30, 1367-462(2022)
4)Sakai, et al., Designing receptor agonists with enhanced pharmacokinetics by grafting macrocyclic peptides into fragment crystallizable regions. Nat Biomed Eng. 7, 164-176(2023)

(図1)抗体Fcの8箇所のループ(T1~B3)のいずれかに、Met受容体結合ペプチドaMD4(15アミノ酸: 赤)を挿入した。Fc分子は2量体であるため、1つのFc分子に対してペプチドが2つ提示される。AlphaFold 2による予測構造(中央)。Plexin受容体やMet受容体に結合する異なるペプチド配列をFcの様々なループ位置に挿入することで、受容体を様々なレベルで活性化または阻害するリガンド模倣体を作成した(右)。
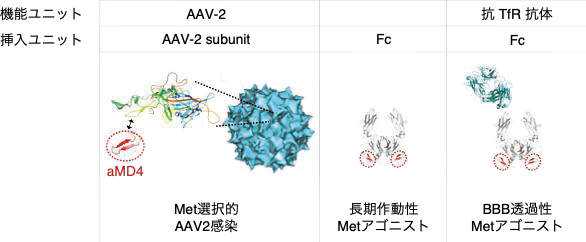
(図2)ペプチドを挿入するスキャフォールドタンパク質の選択によって、付加価値を持ったタンパク質を作成できる。2型アデノ随伴ウイルス(AAV-2)を構成するAAV-2の受容体結合ループをMet受容体結合ペプチドaMD4に置換することで、広範な細胞への感染性をMet特異的に改変した。Fcや抗TfR抗体のFcにaMD4を2つ提示することで、長期作動性MetアゴニストやBBB透過性Metアゴニストを作成した。

ここはどこ? 旅行や美味しいものをいただくことが趣味
高校生へ向けて研究紹介
老化を科学的に理解できる時代が来ています!
がん・老化生物学研究分野
城村 由和
個体老化の主要因の一つである細胞老化とは?
私たちの研究室では、「細胞老化」という現象を研究しています。細胞老化とは、細胞が分裂する能力を失い、増えなくなる状態のことです。これは、人や動物が年を取るにつれて自然に起こるもので、細胞のDNAの端にある「テロメア」という部分が短くなることが主な原因だと考えられています。しかし、最近の研究では、テロメアの短縮以外にも、様々なストレスが細胞老化を引き起こすことが分かってきました。細胞老化によって生じる「老化細胞」は、年を取ると体のいろいろな場所にたまります(図1)。これらの細胞は、「SASP」と呼ばれる特別な物質をたくさん出し、それががんを含む加齢に関連する病気や個体老化の原因になるのではないかと考えられるようになってきました。
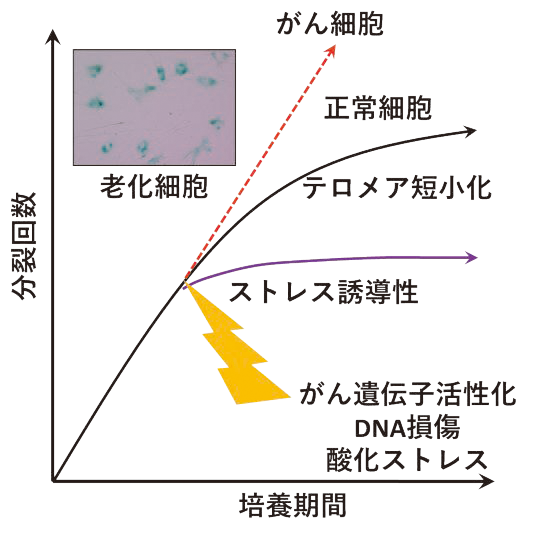
(図1)細胞老化の概略
正常細胞が、テロメアの短小化や内因・外因性のストレスを受けると、がん細胞の元となる異常な細胞が増えることを防ぐために不可逆的な増殖停止を引き起こす現象を細胞老化と呼ぶ。
老化細胞を理解しコントロールすることができれば、100歳を過ぎても健康に!
これまで老化細胞に関しては培養細胞を用いた研究が進められてきましたが、私たちの研究などにより、生体内の老化細胞を可視化したりコントロールすることが可能になってきました。その結果、老化細胞が、体のさまざまな機能に影響を与えていることが分かってきました。例えば、体のエネルギーを作る代謝、神経系、免疫系、血管などが、老化細胞の影響を受けてうまく機能しなくなることがあります。しかし、この現象の詳細はまだよく分かっていません。これらを明らかにするためには、エピゲノム(遺伝子の働きを調節する要素)、ナノ生命科学、生体の複数のシステムを一緒に研究するマルチオミクス、幹細胞生物学、代謝、免疫、病気の生物学といった、多くの分野の知識が必要です。私たちの目標は、老化の基本的な原理を明らかにすることです。さらに、老化細胞を取り除いたり、細胞の老化を遅らせるようにエピゲノムを変えるなど、健康な長寿を実現するための新しい方法を開発することにも取り組んでいます。細胞老化研究は生物学のいろいろな部分に関係していて、たくさんの知識、そして若い柔軟な頭脳が必要です。時には難しいこともありますが、新しい発見がたくさんあるので、研究者にとってはとても面白い分野です。もしこの「老化の研究」に興味がある学生や、将来研究者になりたいと考えている方がいれば、ぜひ私たちの研究室に連絡してください。
研究室のホームページはこちらです https://www.csb-kucri.com
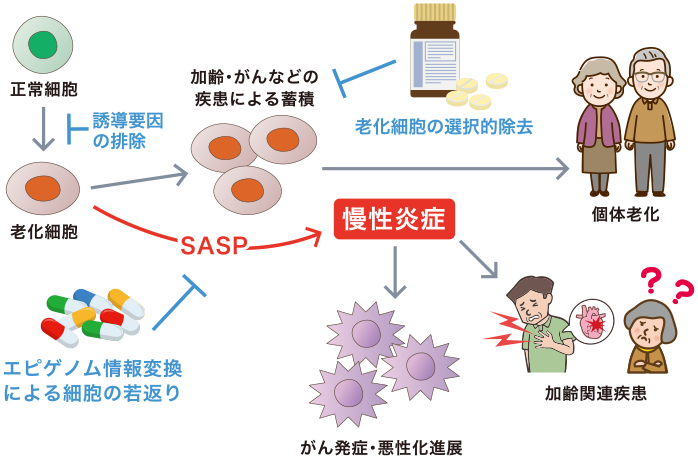
(図2)細胞老化を標的とした先進的な健康寿命延伸法の創出
老化細胞の体内への蓄積を防いだり、蓄積した老化細胞を選択的に除去・若返らせることにより、がんを含めた様々な疾患や個体老化の予防・治療が可能になる。




